Während es mit der Karriere der Pest seit dem 14. Jahrhundert rapide bergab ging, stellen Cholera und vor allem Tuberkulose die Welt noch immer vor große Probleme. Dank der vereinten Mühen von Forscherteams aus Bochum, Leipzig und Braunschweig verstehen wir jetzt besser, wie die Bakterien, die diese Krankheiten verursachen, ihren Angriff auf unser Leib und Leben starten.
Wenn es in unserem Körper demokratisch zuginge, hätten wir jeden Tag Stichwahl: Etwa 40 Billionen (eine 4 mit 13 Nullen) eigene Körperzellen besitzen wir – und etwa genausoviele Bakterien tummeln sich auf unserer Haut, unseren Schleimhäuten und im Darm. Eklig? Keineswegs! Ohne Bakterien könnten wir nicht überleben: Sie wehren Krankheitserreger ab und helfen uns bei der Nahrungsverdauung. Da sie viel kleiner sind als unsere eigenen Körperzellen, fallen sie uns (zum Glück) nicht weiter auf. Aber wehe, eine nicht so wohlmeinende Bakterienzelle dringt ein!
Zu den fiesesten Vertretern der bakteriellen Krankheitserreger gehören Yersinia pestis, Yersinia pseudotuberculosis und Vibrio cholerae – die Namen sind Programm. Die Pest weckt heutzutage höchstens noch geistige Bilder von gruseligen mittelalterlichen Gemälden – sie ist inzwischen relativ harmlos und gut behandelbar. Tuberkulose und Cholera sorgen aber nach wie vor für hohe Todeszahlen, vor allem in ärmeren Ländern mit schlechter Trinkwasserversorgung. Um diese Krankheiten bekämpfen zu können, hilft es ungemein, zu verstehen, wie die Bakterien sie auslösen.
Das haben Forscher um Franz Narberhaus von der Ruhr-Uni Bochum jetzt zumindest teilweise aufgeklärt: Yersinia pestis, Yersinia pseudotuberculosis und Vibrio cholerae enthalten “molekulare Thermometer”. Einfach gesagt sind das Moleküle, die bei kühleren Temperaturen anders aussehen als bei höheren. Dringen die Bakterien in unseren Körper ein, erwärmen sie sich schnell auf unsere Körpertemperatur, also 37 °C. Die Thermometer-Moleküle ändern daraufhin ihre Gestalt und das ist das Angriffssignal – die Pest bricht in uns aus!
Wie funktioniert das genau? Bei den Thermometer-Molekülen handelt es sich um RNA. Das sind Kopien von Genen, die auf der DNA liegen. Die Gene auf unserer DNA stellen Baupläne für Proteine dar. So ein Bauplan darf aber nicht im Original, also als Gen selbst, verwendet werden, sondern es wird eine Kopie gemacht, eben die RNA. Der Bauplan auf der RNA wird von einem Enzym abgelesen, das nach dieser Info dann das Protein herstellt. Dabei kann eine RNA hunderte Male hintereinander abgelesen werden, um viele Exemplare eines Proteins herzustellen. Dasselbe passiert auch in den Bakterien, wenn sie Krankheiten auslösen: Die Bakterien brauchen die Proteine, die so hergestellt werden, um unseren Körper zu befallen. Die RNA für diese Proteine kann nun in zwei Zuständen vorliegen: offen und bereit für die Proteinproduktion oder zusammengefaltet und damit unzugänglich für das Enzym, das sie abliest. Und ihr habt es sicher schon erraten, bei Temperaturen um die 37 °C ist die RNA offen, bei niedrigeren Temperaturen ist sie zusammengefaltet. So wird das Bakterium erst so richtig aktiv, nachdem es in unseren Körper gelangt ist. Die Faltung erfolgt durch Verbindungen, die einzelne Wasserstoffatome innerhalb der selben RNA miteinander schließen. Bei höheren Temperaturen werden diese Verbindungen instabil und die RNA schmilzt regelrecht auf.
Die Frage aller Fragen: Kann man das für Medikamente benutzen? Zwei Antworten: “Ja” und “Noch nicht”. Prinzipiell ist es nicht schwierig, Wirkstoffe herzustellen, die das Aufschmelzen der RNA verhindern und damit die Bakterien zur Untätigkeit zwingen. Das Problem ist jedoch, diese Wirkstoffe halbwegs gezielt durch den Körper zu den Bakterien zu bringen. Und dann müssen sie ihn auch noch aufnehmen. Das ist gar nicht so einfach, eine Bakterienzelle – so wie alle Zellen aller Lebwesen – nehmen nicht einfach so irgendeinen Stoff auf, der gerade vorbeischwimmt. Er könnte ja giftig sein. Was in diesem Fall genau der Zweck wäre. Aber um herauszufinden, wie man die Bakterien so auszutricksen kann, dass die so ein Medikament aufnehmen, müssen Wissenschaftler noch ein bisschen weiterforschen. Immerhin, ein Anfang ist gemacht!
Für die Streber unter uns gibt es hier die Original-Publikation (leider nur, wenn man registriert ist): www.pnas.org/content/early/2016/06/10/1523004113.abstract
Righetti F, et al. Proc Natl Acad Sci USA. (2016 Jun 13)

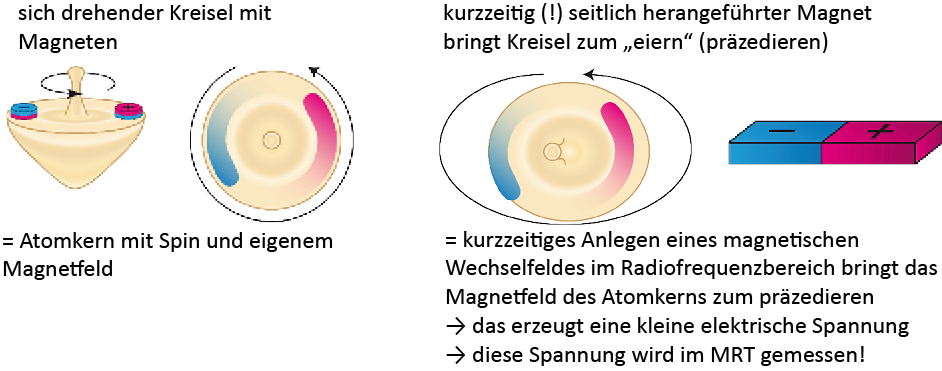
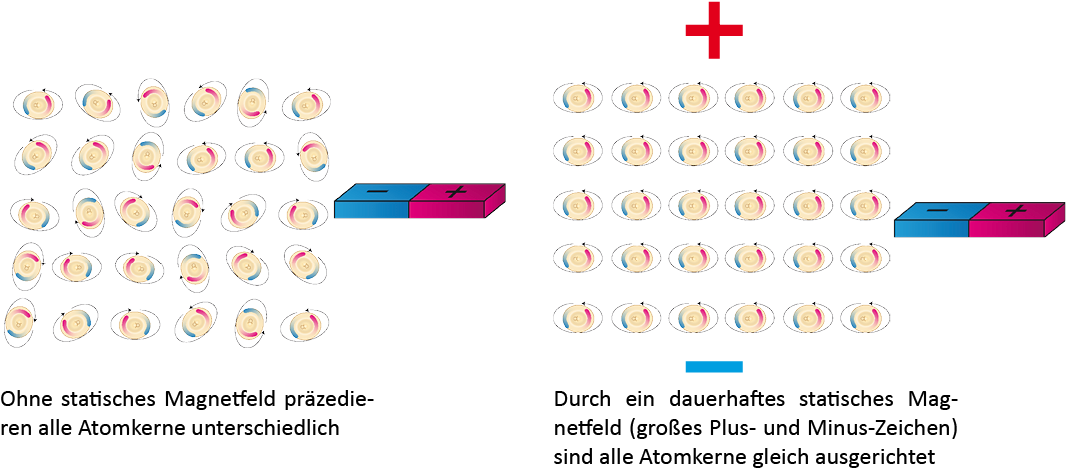
 Die Abkürzung “MRT” hat jeder bestimmt schonmal gehört. Die drei Buchstaben stehen für das Wort “Magnetresonanztomografie”.Bei einem Magnetresonanztomografen handelt es sich um eine der berüchtigten “Röhren”, in die man geschoben wird, wenn die Ärzte nicht so richtig wissen, was man hat. Anders als die Computertomografie – auch so eine “Röhre” im Krankenhaus – arbeitet die MRT nicht mit eventuell schädlicher Röntgenstrahlung, sondern mit Magnetfeldern. In der folgenden Box könnt ihr nachlesen, wie MRT funktioniert.
Die Abkürzung “MRT” hat jeder bestimmt schonmal gehört. Die drei Buchstaben stehen für das Wort “Magnetresonanztomografie”.Bei einem Magnetresonanztomografen handelt es sich um eine der berüchtigten “Röhren”, in die man geschoben wird, wenn die Ärzte nicht so richtig wissen, was man hat. Anders als die Computertomografie – auch so eine “Röhre” im Krankenhaus – arbeitet die MRT nicht mit eventuell schädlicher Röntgenstrahlung, sondern mit Magnetfeldern. In der folgenden Box könnt ihr nachlesen, wie MRT funktioniert.